【内审员培训】《GB/T42061-2022/ISO13485:2016 内审员》培训通知
序言
国家市场监督管理总局/国家标准化管理委员会于2022年10月12日发布了GB/T 42061-2022《医疗器械 质量管理体系 用于法规的要求》,并将于2023年11月1日正式实施。该要求是原YY/T 0287-2017在贯彻落实相关质量管理的法律法规基础上,为进一步提升医疗器械全生命周期的实施影响力,升级成为了国家标准。这有力凸显了质量管理体系在行业监管中的重要性。
自2021年6月1日新版《医疗器械监督管理条例》实施以来,药监部门陆续发布了一系列新的医疗器械法规,结合国内各类生产企业产品备案/注册、日常监督、飞行检查必须执行/落实的《医疗器械生产质量管理规范》和特定产品“附录”,动态系统地为医疗器械行业及其供应链相关参与方持续健康发展提供技术支撑。
为使企业充分理解和落实“标准”和“规范”要求、协助质量管理体系顺利升级,以适应国家行政检查和第三方认证检查,解决企业在实际操作中遇到的问题,常州飞凡实训中心特举办《GB/T 42061-2022/ISO 13485:2016 & GB/T 19001-2016/ISO 9001:2015内审员》转版培训课程。
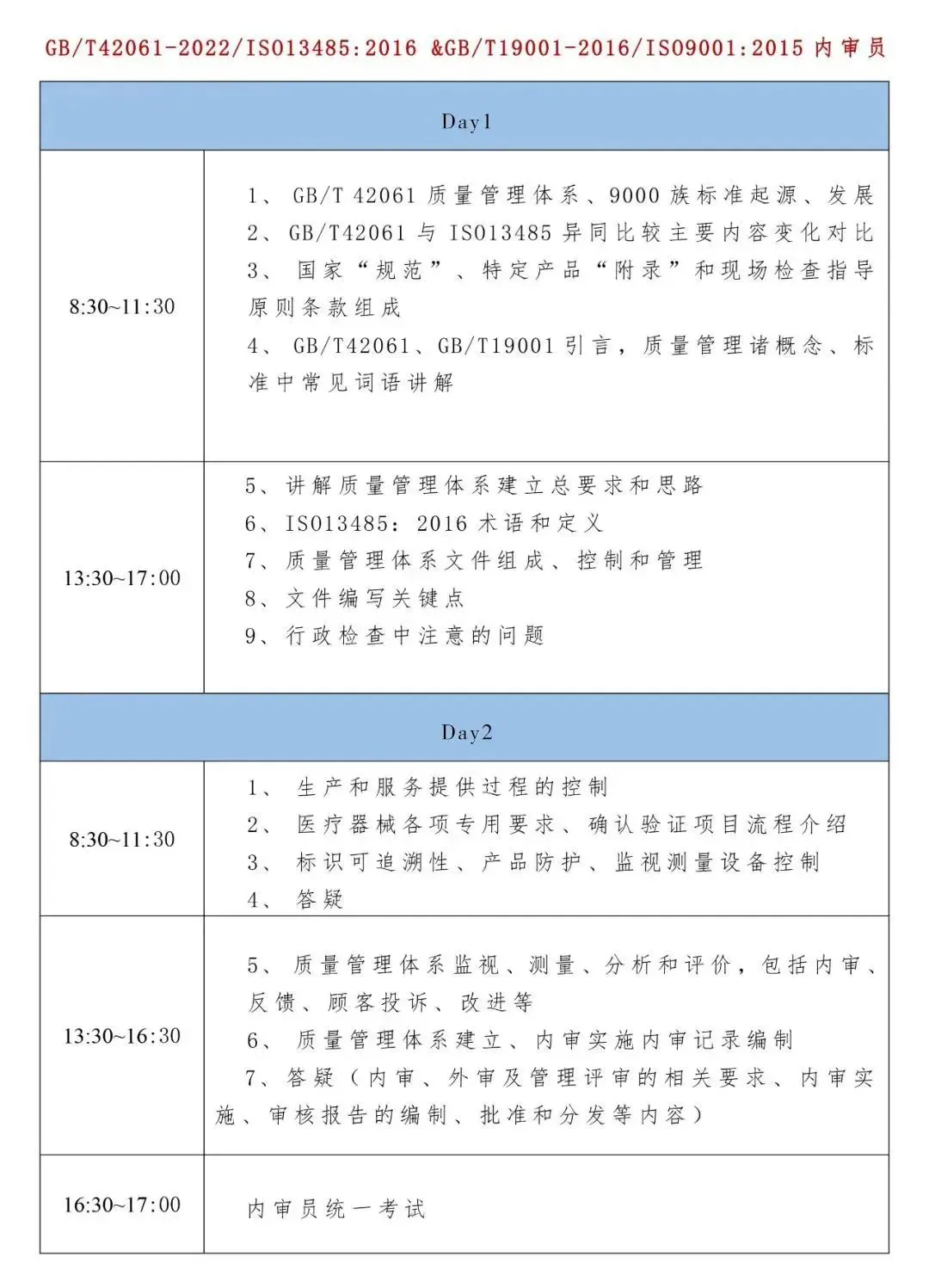
一、培训内容讲解说明:
以GB/T42061-2022标准为主线,对比讲解《医疗器械生产质量管理规范现场检查指导原则》(逐条)和ISO13485-2016标准,并按标准和“规范”逐条讲解操作要点。
1、质量管理体系基础术语及管理原则;
2、GB/T42061-2022/IS013485:2016标准详解;
3、IS09001:2015标准讲解;
4、质量管理体系建立及文件编写;
5、内审程序、方法与技巧。
【培训方式】
线上线下同时进行培训
【时间】
(注:按照月份顺序安排培训课程)
2023年12月14日-12月15日
【地点】
飞凡医疗GMP实训中心A6四楼
【培训对象】
管理者代表、各部门负责人、产品注册人员、体系专员、工艺工程师、检验员,以及医疗器械行业监管人员。
二、专业讲座快速收心何老师
毕业于浙江科技大学,至今工作35年,主要负责建立和维护ISO13485质量管理体系,并在此基础上针对企业产品的不同销售国,使公司的质量管理体系能符合不同销售国的法规要求,如:欧盟的93/42 EEC MDD认证要求,美国US 21 CFR Part 820要求,加拿大的CMDCAS的要求等。
/ 报名方式 /
请扫码报名,场地有限先报先得

扫描上方二维码报名参加培训
考核通过后领取培训证书
(培训信息可查询)
培训费用及缴费方式
培训费用:
非会员2500元/人 会员1800元/人
缴费方式:
公司名称:常州飞凡教育科技有限公司
开户行:中国银行股份有限公司常州马杭支行
账号:492380037763
四、联系人


